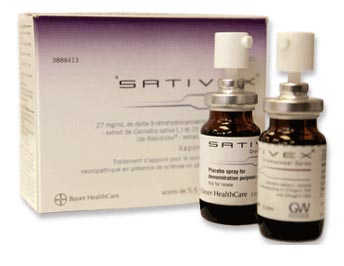
Une nouvelle étape vient d'être franchie avec succès dans le processus de commercialisation du Sativex en Europe:
Sur MSRC:
La reconnaissance mutuelle pour le Sativex se termine par une recommandation d'approbation dans dix pays européens
GW Pharmaceuticals plc et Almirall SA annoncent aujourd'hui avoir passé avec succès la procédure européenne de reconnaissance mutuelle (MRP) pour le Sativex ®, spray buccal pour le traitement de la spasticité due à la sclérose en plaques (SEP).
Après les précédentes soumissions réglementaires positives pour le Royaume-Uni, l’Espagne, l’Allemagne, l'Italie, le Danemark, la Suède, l’Autriche, la République tchèque, une application MRP a été effectuée afin d'étendre la disponibilité de Sativex ® à dix autres pays européens.
Le MRP a maintenant conclu avec succès auprès des autorités réglementaires pour les dix pays, confirmant que le Sativex ® répond à leurs exigences pour l’approbation. Les pays impliqués, et pour lesquels le Sativex ® devrait être approuvé sont les suivants: la Belgique, la Finlande, l’Islande, l’Irlande, le Luxembourg, les Pays-Bas, la Norvège, la Pologne, le Portugal et la Slovaquie.
"Pour Almirall, la réussite de cette seconde étape réglementaire au MRP pour le Sativex ® est une très bonne nouvelle et renforce notre engagement à développer ce médicament novateur pour les patients atteints de SEP en Europe.
Sativex ® est le premier traitement spécifiquement indiqué pour le traitement de la spasticité , et des symptômes connexes, chez les patients SEP " a déclaré Bertil Lindmark, directeur scientifique de Almirall.
La prochaine étape dans le processus de réglementation se distinguera par des phases nationales dans chaque pays afin de finaliser le libellé local sur l'emballage du produit et les documents connexes et aussi dans le but de se mettre d'accord sur les exigences spécifiques de chacun des pays. Après l'achèvement de l'étape nationale, chaque pays devrait ensuite délivrer une autorisation de mise sur le marché national. Le moment du lancement dans ces dix nouveaux pays est tributaire des prix nationaux et des procédures de remboursement. Les lancements sont prévus à partir de la fin de 2012.
Dr Stephen Wright, R GW & D, a déclaré, «Ce qui nouveau aujourd'hui, c’est que les autorités réglementaires ont maintenant recommandé l’approbation pour Sativex ® dans 18 pays européens. Le succès de cette étape réglementaire récente fournit l'approbation supplémentaire concernant la qualité, la sécurité et l'efficacité de Sativex ®.
Sativex ® a un rôle important dans la satisfaction des besoins des personnes atteintes de sclérose en plaques et nous sommes impatients de travailler avec notre partenaire Almirall afin de rendre le médicament disponible pour les patients en Europe."
En Europe, le Sativex ® est approuvé et commercialisé pour la spasticité dans la sclérose en plaques au Royaume-Uni, en Espagne, en Allemagne et au Danemark. En plus des dix nouveaux marchés européens inclus dans cette MRP, le lancement est également en cours de planification en Suède, en Italie, en Autriche et en République tchèque.
En plus de la spasticité pour la SEP, le Sativex ® également développé par GW Pharmaceuticals, est actuellement en essai clinique de phase III de pour le traitement de la douleur cancéreuse.
Almirall détient les droits de commercialisation de ce médicament pour l’Europe (à l'exception du Royaume-Uni) et pour le Mexique.
Source: GW Pharmaceuticals plc (05/08/12)





 sativex_fs_fd_109461-fra.pdf
sativex_fs_fd_109461-fra.pdf