Longtemps cantonnée à la recherche pure, l’épigénétique pose ses jalons en médecine humaine. Et pour des pathologies majeures, puisque cette branche de la biologie pourrait apporter les réponses à certaines maladies du système immunitaire. Cela a été révélé lors du dernier congrès international sur les maladies auto-immunes qui s’est tenu à Nice en mars, offrant ainsi l’espoir de nouveaux traitements et d’une approche thérapeutique inédite.
Car avec la montée en puissance de l’épigénétique, est en train de surgir un tout nouveau paradigme aux conséquences majeures pour la médecine : prendre de la hauteur sur les gènes et se focaliser non pas uniquement sur leur contenu (ce qu’ils signifient) mais également sur leur gestion et leur organisation.
La troisième cause de morbidité en France
Prise séparément, chacune des maladies auto-immunes est une maladie rare avec un cas sur quelques dizaines de milliers de personnes. Mais, ensemble, elles représentent la troisième cause de morbidité dans les pays industrialisés après les cancers et les maladies cardio-vasculaires. Le terme rassemble sous une seule étiquette un cortège d’affections qui n’ont, en vérité, pas grand-chose à voir les unes avec les autres. Quoi de commun entre le lupus, la sclérose en plaques, le diabète et la maladie de Crohn ?
Chacune concerne des organes différents, quelquefois le corps entier, et se manifeste par des symptômes très variables. Mais toutes ont un point commun : leur genèse. Car toutes découlent d’un dérèglement du système immunitaire. Alors que celui-ci est conçu pour réagir et défendre l’organisme uniquement en cas d’attaque extérieure, par un virus par exemple, il échappe à son programme et ne fait plus la différence entre son propre camp et "l’ennemi". Le système immunitaire produit alors des lymphocytes et des anticorps qui attaquent les propres cellules de l’organisme comme si elles lui étaient étrangères.
Dès lors, les dégâts peuvent se limiter à un organe comme le foie pour certaines hépatites, le pancréas pour le diabète, la thyroïde pour la maladie de Basedow, ou s’étendre à tout l’organisme comme pour la polyarthrite rhumatoïde ou le lupus.
Chaque malade présente un profil particulier
Mis à part cette origine commune, non seulement ces pathologies sont très différentes entre elles mais, de plus, une même maladie ne se manifestera pas de la même façon d’un patient à un autre. L’exemple le plus emblématique de cette singularité, du moins le plus connu car médiatisé par la série télévisée Dr House, est le lupus. Souvent suspectée par le célèbre diagnosticien et son équipe lors de leurs enquêtes, au point d’en devenir un gag récurrent, cette affection est effectivement "très compliquée à repérer, confirme Sylviane Muller, du CNRS de Strasbourg. Chaque malade a un profil particulier".
Conséquence : "les médicaments les plus en pointe actuellement, des biothérapies constituées d’anticorps monoclonaux, ne fonctionnent pas très bien dans un tiers des cas, explique Yves Renaudineau, de l’équipe Inserm Espri du centre hospitalier régional universitaire de Brest. Ainsi, les immunothérapies, qui ont révolutionné la vie de certains patients, donnent des résultats très variables sur d’autres et demeurent hors de prix, environ 50 000 € par an et par malade." Il existe des familles présentant plus de risques que d’autres de contracter ces pathologies. Ainsi, de 0,4 % dans la population globale, le risque passe à 5 % dans ces familles prédisposées génétiquement.
Mais la génétique n’explique pas tout. Sinon, comment comprendre que de vrais jumeaux, qui partagent l’intégralité de leur bagage génétique, ne soient pas frappés des mêmes maux au cours de leur existence ? Et c’est là que l’épigénétique pourrait fournir les premiers éléments de réponse en introduisant un peu de lamarckisme — du nom du naturaliste français du XIXe siècle qui fut le premier à théoriser que l’environnement pouvait avoir un effet sur les espèces vivantes — dans le tableau. En effet, l’environ- nement aurait non seulement une influence sur les gènes — ou plus précisément sur leur expression— mais de plus celle-ci pourrait se transmettre d’une génération à une autre !
L’exemple le mieux documenté à ce jour remonte au terrible hiver 1944-1945 au cours duquel une famine impitoyable frappa toutes les villes de l’ouest des Pays-Bas.
Le patrimoine génétique peut être influencé
Les enfants des mères sous-alimentées ne furent pas les seuls à souffrir de rachitisme car cette affection fut retrouvée chez leurs petits-enfants. La famine — l’environnement — a ainsi provoqué des dommages dans le patrimoine génétique qui se sont répercutés sur plusieurs générations.
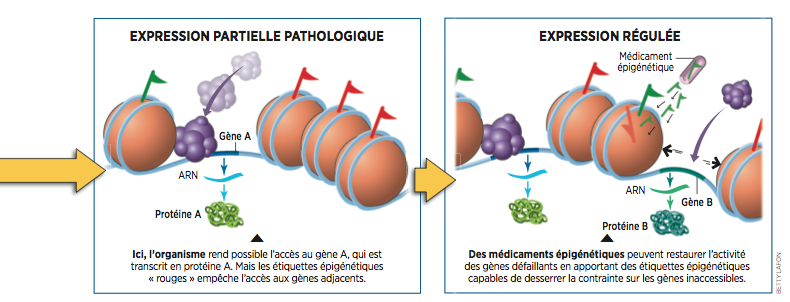
Contrairement à ce que l’on a pu penser, ce n’est donc pas seulement le contenu du bagage génétique, les gènes, qui est transmis mais également la manière dont il est rangé et organisé. Cette nouvelle compréhension des maladies auto-immunes pourrait ouvrir la voie à de nouvelles thérapeutiques. En effet, les marques épigénétiques sont aux gènes ce que les Post-it sont aux graffitis muraux : elles s’enlèvent et se recollent facilement. Et cela change tout ! "C’est une révolution dans l’approche des maladies !", s’enthousiasme Yves Renaudineau. Car certaines pathologies pourraient ainsi ne pas être "gravées dans le marbre" génétique. "Les facteurs épigénétiques pourraient même avoir une plus grande importance que les génétiques.
Et si les maladies auto-immunes dépendent de tels marqueurs épigénétiques, cela signifie qu’elles sont réversibles." D’ailleurs, les médecins, et encore plus les malades, le savent bien : ces affections évoluent largement au fil du temps. Aux phases actives, les poussées, succèdent des phases de rémission où les douleurs sont en sommeil avant de repartir de plus belle à la suite d’un stress, d’une exposition aux rayons X ou même sans raison claire.
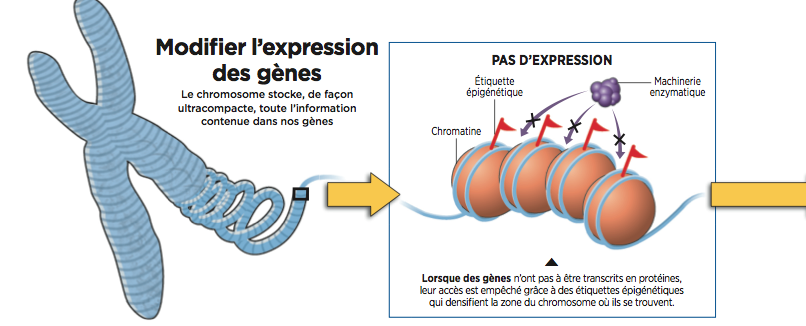
De là à envisager le traitement des maladies auto-immunes en rétablissant un étiquetage correct des gènes, il n’y a qu’un pas... qui a déjà été franchi pour certaines étiquettes (voir infographie ci-dessous).
© Betty Lafon / Sciences et Avenir
Car des médicaments épigénétiques existent déjà pour d’autres pathologies, principalement chez la souris mais pas seulement. Pour l’être humain, la chimiothérapie anticancer associe désormais des molécules chargées de supprimer l’une des étiquettes épigénétiques qui se trouvent en excès lors des processus tumoraux, en l’occurrence la méthylation de l’ADN.
Yves Renaudineau en est persuadé : l’épigénétique profitera au traitement des maladies auto-immunes. "Elle conduira sous peu à de nouvelles thérapies, ou à une meilleure utilisation des thérapies actuelles. En tout cas, elle s’apprête à révolutionner le domaine", affirme le chercheur. Réponse dans une dizaine d’années.
NUMÉRIQUE. Cet article est extrait de Sciences et Avenir 811. Le magazine est disponible à l'achat en version numérique via l'encadré ci-dessous.
Car avec la montée en puissance de l’épigénétique, est en train de surgir un tout nouveau paradigme aux conséquences majeures pour la médecine : prendre de la hauteur sur les gènes et se focaliser non pas uniquement sur leur contenu (ce qu’ils signifient) mais également sur leur gestion et leur organisation.
La troisième cause de morbidité en France
Prise séparément, chacune des maladies auto-immunes est une maladie rare avec un cas sur quelques dizaines de milliers de personnes. Mais, ensemble, elles représentent la troisième cause de morbidité dans les pays industrialisés après les cancers et les maladies cardio-vasculaires. Le terme rassemble sous une seule étiquette un cortège d’affections qui n’ont, en vérité, pas grand-chose à voir les unes avec les autres. Quoi de commun entre le lupus, la sclérose en plaques, le diabète et la maladie de Crohn ?Chacune concerne des organes différents, quelquefois le corps entier, et se manifeste par des symptômes très variables. Mais toutes ont un point commun : leur genèse. Car toutes découlent d’un dérèglement du système immunitaire. Alors que celui-ci est conçu pour réagir et défendre l’organisme uniquement en cas d’attaque extérieure, par un virus par exemple, il échappe à son programme et ne fait plus la différence entre son propre camp et "l’ennemi". Le système immunitaire produit alors des lymphocytes et des anticorps qui attaquent les propres cellules de l’organisme comme si elles lui étaient étrangères.
Dès lors, les dégâts peuvent se limiter à un organe comme le foie pour certaines hépatites, le pancréas pour le diabète, la thyroïde pour la maladie de Basedow, ou s’étendre à tout l’organisme comme pour la polyarthrite rhumatoïde ou le lupus.
Chaque malade présente un profil particulier
Mis à part cette origine commune, non seulement ces pathologies sont très différentes entre elles mais, de plus, une même maladie ne se manifestera pas de la même façon d’un patient à un autre. L’exemple le plus emblématique de cette singularité, du moins le plus connu car médiatisé par la série télévisée Dr House, est le lupus. Souvent suspectée par le célèbre diagnosticien et son équipe lors de leurs enquêtes, au point d’en devenir un gag récurrent, cette affection est effectivement "très compliquée à repérer, confirme Sylviane Muller, du CNRS de Strasbourg. Chaque malade a un profil particulier". Conséquence : "les médicaments les plus en pointe actuellement, des biothérapies constituées d’anticorps monoclonaux, ne fonctionnent pas très bien dans un tiers des cas, explique Yves Renaudineau, de l’équipe Inserm Espri du centre hospitalier régional universitaire de Brest. Ainsi, les immunothérapies, qui ont révolutionné la vie de certains patients, donnent des résultats très variables sur d’autres et demeurent hors de prix, environ 50 000 € par an et par malade." Il existe des familles présentant plus de risques que d’autres de contracter ces pathologies. Ainsi, de 0,4 % dans la population globale, le risque passe à 5 % dans ces familles prédisposées génétiquement.
Mais la génétique n’explique pas tout. Sinon, comment comprendre que de vrais jumeaux, qui partagent l’intégralité de leur bagage génétique, ne soient pas frappés des mêmes maux au cours de leur existence ? Et c’est là que l’épigénétique pourrait fournir les premiers éléments de réponse en introduisant un peu de lamarckisme — du nom du naturaliste français du XIXe siècle qui fut le premier à théoriser que l’environnement pouvait avoir un effet sur les espèces vivantes — dans le tableau. En effet, l’environ- nement aurait non seulement une influence sur les gènes — ou plus précisément sur leur expression— mais de plus celle-ci pourrait se transmettre d’une génération à une autre !
L’exemple le mieux documenté à ce jour remonte au terrible hiver 1944-1945 au cours duquel une famine impitoyable frappa toutes les villes de l’ouest des Pays-Bas.
Le patrimoine génétique peut être influencé
Les enfants des mères sous-alimentées ne furent pas les seuls à souffrir de rachitisme car cette affection fut retrouvée chez leurs petits-enfants. La famine — l’environnement — a ainsi provoqué des dommages dans le patrimoine génétique qui se sont répercutés sur plusieurs générations. Contrairement à ce que l’on a pu penser, ce n’est donc pas seulement le contenu du bagage génétique, les gènes, qui est transmis mais également la manière dont il est rangé et organisé. Cette nouvelle compréhension des maladies auto-immunes pourrait ouvrir la voie à de nouvelles thérapeutiques. En effet, les marques épigénétiques sont aux gènes ce que les Post-it sont aux graffitis muraux : elles s’enlèvent et se recollent facilement. Et cela change tout ! "C’est une révolution dans l’approche des maladies !", s’enthousiasme Yves Renaudineau. Car certaines pathologies pourraient ainsi ne pas être "gravées dans le marbre" génétique. "Les facteurs épigénétiques pourraient même avoir une plus grande importance que les génétiques.
Et si les maladies auto-immunes dépendent de tels marqueurs épigénétiques, cela signifie qu’elles sont réversibles." D’ailleurs, les médecins, et encore plus les malades, le savent bien : ces affections évoluent largement au fil du temps. Aux phases actives, les poussées, succèdent des phases de rémission où les douleurs sont en sommeil avant de repartir de plus belle à la suite d’un stress, d’une exposition aux rayons X ou même sans raison claire.
De là à envisager le traitement des maladies auto-immunes en rétablissant un étiquetage correct des gènes, il n’y a qu’un pas... qui a déjà été franchi pour certaines étiquettes (voir infographie ci-dessous).


© Betty Lafon / Sciences et Avenir
Car des médicaments épigénétiques existent déjà pour d’autres pathologies, principalement chez la souris mais pas seulement. Pour l’être humain, la chimiothérapie anticancer associe désormais des molécules chargées de supprimer l’une des étiquettes épigénétiques qui se trouvent en excès lors des processus tumoraux, en l’occurrence la méthylation de l’ADN.
Yves Renaudineau en est persuadé : l’épigénétique profitera au traitement des maladies auto-immunes. "Elle conduira sous peu à de nouvelles thérapies, ou à une meilleure utilisation des thérapies actuelles. En tout cas, elle s’apprête à révolutionner le domaine", affirme le chercheur. Réponse dans une dizaine d’années.
NUMÉRIQUE. Cet article est extrait de Sciences et Avenir 811. Le magazine est disponible à l'achat en version numérique via l'encadré ci-dessous.





